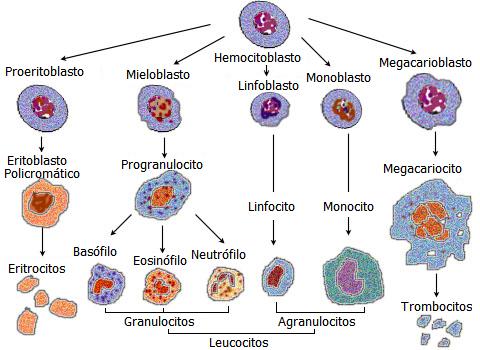
La producción de células sanguíneas
-hematopoyesis- es un proceso complejo a través del cual las células troncales hematopoyéticas proliferan y se diferencian, dando lugar a los distintos tipos de células maduras circulantes
(i.e., eritrocitos, granulocitos, linfocitos, monocitos y plaquetas). La hematopoyesis tiene lugar en la médula ósea, en donde una intrincada red de células estromales y sus productos, regulan cada una de las etapas que conducen a la generación de células primitivas, intermedias y maduras. Alteraciones en la hematopoyesis pueden conducir a situaciones de sobre producción de células hematopoyéticas (como las leucemias), o a una producción deficiente de las mismas (como en la anemia a plástica). El estudio de la hematopoyesis tiene implicaciones, no solo de tipo biológico, sino en el campo de la hematología clínica y la medicina regenerativa.
Introducción•
Diariamente se producen en nuestro organismo cantidades extraordinarias de células sanguíneas.
Por ejemplo, en un adulto de 70 kg de peso, se producen 2 x 1011 eritrocitos, 2 x 1011 plaquetas y
7 x 1010 granulocitos (1). Lo anterior compensa la pérdida diaria de dichas células de tal manera que, en condiciones normales, los niveles en circulación de eritrocitos, leucocitos y plaquetas se mantienen constantes. El proceso a través del cual se generan las células de la sangre se denomina hematopoyesis y ocurre bajo condiciones muy específicas en el interior de los huesos, en la llamada médula ósea (2). La hematopoyesis es un proceso extraordinariamente complejo en el que intervienen una gran variedad de tipos celulares y el cual es regulado por diversos factores. Hoy en día, y gracias al avance en diversos campos de la biología -como la inmunología, la genética molecular, el cultivo celular, la microscopia electrónica, y la bioquímica, por nombrar algunos- se ha logrado obtener un panorama
muy amplio y detallado de este proceso.
Organización del Sistema Hematopoyético•
Compartimientos Celulares
El sistema hematopoyético puede ser dividido en base al grado de madurez de las células que lo conforman y a los distintos linajes celulares que de él se generan. De acuerdo al grado de maduración
celular, se han identificado cuatro compartimentos.
El primer compartimiento corresponde a las células más primitivas, llamadas células troncales hematopoyéticas (CTH). Estas células tienen dos características funcionales que las distinguen: son capaces de auto-renovarse (al dividirse, por lo menos una de las células hijas conserva las propiedades de la célula
madre) y son multipotenciales (pueden dar origen a los distintos linajes sanguíneos). Las CTHcorrespondenal 0.01% del total de células nucleadas presentes en la médula ósea, por lo que su estudio puede verse limitado desde el punto de vista práctico. Sin embargo, gracias a los estudios realizados hasta ahora sabemos que estas células tiene una morfología linfoblastoide, las cuales expresan antígenos como
CD34, CD90, CD117 y CD133, y que carecen de la expresión de antígenos de linajes específicos, como CD3, CD4, CD8, CD19, CD20, CD33, CD38, CD45, CD57, CD71, Glicoforina A, etc. (3).
Las CTH dan origen a células progenitoras hematopoyéticas (CPH), las cuales han perdido su capacidad
de auto-renovación, pero conservan su potencial proliferativo. Estas pueden ser multipotenciales, o bien, pueden estar restringidas a dos (bipotenciales) o a un solo linaje (monopotenciales). Las CPH constituyen
el segundo compartimiento del sistema hematopoyé-tico, el cual corresponde a <0.5% del total de células
de la médula ósea; comparten ciertas características inmunofenotípicas con las CTH, como la expresión
del antígeno CD34, sin embargo, presentan patrones de expresión de marcadores celulares muy particulares, de acuerdo al linaje al que pertenecen (4). Las CPH dan lugar a células precursoras reconocibles por su morfología (tercer compartimiento), las cuales, a pesar de ser inmaduras, pueden ser identificadas en frotis de médula ósea a través de microscopía de luz. Las células precursoras constituyen la gran mayoría de las células de la médula ósea (>90% de las células hematopoyéticas residentes
en la cavidad medular). Finalmente, los precursores hematopoyéticos al madurar, generan a las células
sanguíneas circulantes (cuarto compartimiento).Generación de Linajes Hematopoyéticos
Las células de la sangre se dividen en dos grandes grupos: mieloides y linfoides. Las primeras comprenden a los granulocitos (neutrófilos, basófilos y eosinófilos), monocitos, eritrocitos y trombocitos, mientras que las segundas comprenden a los linfocitos B, linfocitos T y células NK. Las células
mieloides son producidas a través de un proceso conocido como mielopoyesis, mientras que las
linfoides son resultado de la linfopoyesis. Ambos procesos, si bien independientes, están muy relacionados y la interacción que existe entre células de uno y otro es muy estrecha.
Mielopoyesis•
Al igual que el resto de la hematopoyesis, la mielopoyesis toma lugar dentro de la medula ósea,
sitio en donde las células troncales hematopoyéticas dan lugar a los progenitores mieloides comunes (PMC). Los PMC son células con una alta capacidad proliferativa (y por lo tanto activas en el ciclo celular), pero incapaces de auto-renovarse y cuyo potencial de diferenciación está restringido
a linajes específicos; estas células son responsivas a un determinado tipo y número de citocinas,
evento que está definido por el número de receptores que cada progenitor presenta (5). Los PMC subsecuentemente se pueden diferenciar en progenitores más específicos, tales como los
progenitores granulo-monocíticos (PGM), y los progenitores eritroides-megacariocíticos (PEM)
(6).La maduración posterior en cada uno de los linajes hematopoyéticos está definida por dos procesos fundamentales: la pérdida definitiva del potencial de auto-renovación y la adquisición de una
identidad específica. Estos procesos son controlados por programas genéticos en donde los genes
que mantienen la capacidad de auto-renovación se apagan, al tiempo que los genes que regulan
la diferenciación se encienden. De esta manera, los progenitores hematopoyéticos se diferencian a
células precursoras, a través de una serie de eventos en donde grupos alternados de genes en asociación con diversos factores de crecimiento determinan el destino celular en donde cada célula madura tiene una identidad y función definitiva.Entre los principales genes involucrados en la diferenciación al linaje mieloide se encuentran: PU.1 (7), Hox (8), C/EBPa, C/EBPb y C/EPBe
(9), RUNX1 (10) y SCL (11). Cabe hacer notar que altos niveles de expresión de PU.1 se asocian con la diferenciación granulocítica, mientras que su baja expresión se asocia con diferenciación hacia el linaje eritroide (7). PU.1, junto con los factores de transcripción GATA 1, GATA 2 y FOG, son esenciales para la maduración y diferenciación eritroide y megacariocítica (12,13). Una vez que los factores de transcripción se encienden o apagan son capaces de inducir la expresión de receptores de factores de crecimiento involucrados con la diferenciación eritroide, megacariocítica y granulo-monocítica.
Progenitores Eritroides
Diversos sistemas de cultivo han demostrado que los progenitores eritroides tienen diferente
potencial proliferativo. Los progenitores eritroides más primitivos son denominados unidades formadoras de brotes eritroides (del inglés BFUE), las cuales mantienen una alta tasa de proliferación en respuesta a citocinas, mientras que los progenitores eritroides más maduros, denominados unidades formadoras de colonias eritroides (del inglés CFU-E) tienen un limitado potencial de proliferación. Estos progenitores dan lugar a precursores eritroides, dentro de los que se incluyen proeritroblastos, eritroblastos basófilos,eritroblastos policromatófilos, eritroblastos orocromáticos, y reticulocitos; estos últimos, a su vez, dan origen a los eritrocitos.
A lo largo de esta ruta de diferenciación, la eritropoyetina (EPO) actúa como una de las principales citocinas reguladoras de la eritropoyesis. Esta molécula es producida por células renales y en menor proporción por células hepáticas. La principal actividad de la EPO es controlar la producción de células eritroides a través de la promoción de la sobrevivencia, proliferación y diferenciación de progenitores eritroides en la médula ósea. En células progenitoras eritroides tempranas (BFU-E), la EPO actúa como agente mitogénico y promueve su proliferación, mientras que en progenitores eritroides tardíos (CFU-E), actúa como agente de sobrevivencia (14). Es importante destacar que además de la EPO, citocinas como interleucina 3 (IL-3), trombopoyetina (TPO), ligando de la tirosina fetal 3 (FLT-3L) y el factor de células seminales (SCF) participan también en la eritropoyesis; estas citocinas son capaces
de sinergizar con EPO y regular la proliferación, diferenciación y sobrevivencia de células progenitoras y precursores eritroides (15).
Progenitores Megacariocíticos
En relación a los progenitores megacariocíticos, una clasificación jerárquica ha sido desarrollada
con base en sus potenciales de proliferación y la expresión de c-mpl (el receptor de trombopoyetina) en su superficie. Los progenitores más tempranos son definidos como células formadoras de brotes megacariocíticos (meg-BFC) y son capaces de formar colonias de alrededor de 100 células, después de 21 días de cultivo. Estos meg-BFC dan lugar a células formadoras de colonias de megacariocitos (meg-CFC) que representan a los progenitores tardíos, capaces de formar pequeñas colonias después de 12 días de cultivo. Estos meg-CFC a lo largo de 5 a 7 días, tienen diversas endomitosis (replicación del ADN sin división nuclear), que conducen a la formación de precursores poliploides denominados megacariocitos inmaduros, quienes una vez que desarrollan un citoplasma maduro dan lugar a megacariocitos maduros, que eventualmente darán lugar a las plaquetas (Fig. 2). A lo largo de todo el proceso de diferenciación megacariocítica, el elemento regulador clave es la trombopoyetina, ya que promueve el crecimiento de los meg-CFC, incrementando sustancialmente la tasa de endocitosis y estimulando la diferenciación a megacariocitos maduros. Algunas otras citocinas involucradas con este proceso son IL-3, IL-6 e IL-11.
Progenitores Granulo-Monocíticos
Los progenitores mieloides por su parte incluyen unidades formadoras de colonias granulo-monociP
tícas (del inglés CFU-GM), que a su vez dan origen a unidades formadoras de colonias granulocitícas
(del inglés CFU-G) y unidades formadoras de colonias monocitícas (del inglés CFU-M). Una vez
encaminadas en la vía de diferenciación, las CFUG dan lugar a mieloblastos, promielocitos, mielocitos, metamielocitos y células maduras (eosinofilos, neutrofilos y basofilos). Mientras que las
CFU-M dan lugar a monoblastos, promonocitos, monocitos, y finalmente macrófagos (Fig. 3).
A lo largo de toda la ruta de diferenciación, las células de linaje mieloide son reguladas por un
amplio número de citocinas entre las que se encentran: el factor estimulador de colonias de
granulocitos y monocitos (GM-CSF), el factor estimulador de colonias de granulocitos (G-CSF), el
factor estimulador de colonias de monocitos (MCSF), la interleucina-3 (IL-3), IL-6 y el factor de
células seminales (SCF), entre muchas otras.
Los factores estimuladores de colonias son capaces de inducir la sobrevivencia y proliferación de células progenitoras hematopoyéticas, conduciéndolas hacia linajes específicos (macrofágico, megacariocí-tico, neutrofílico), dependiendo de la combinación de factores empleados. De esta forma, por ejemplo, el G-CSF tiene un efecto más específico para la diferenciación a linaje granulocítico, en donde, además de inducir la diferenciación, incrementa la funcionalidad de las células maduras (16,17).
Aunado a lo anterior, se sabe que citocinas como el SCF y el Flt-3L por sí solos son capaces de estimular el crecimiento de células troncales y progenitoras hematopoyéticas, así como de los linajes
linfoides y mieloides, aunque tienden a tener un mayor efecto cuando actúan en combinación con otros factores de crecimiento, como GM-CSF, IL-3, IL-6, G-CSF, TPO y EPO (18,19).
Cabe mencionar que además de las citocinas estimuladoras de la mielopoyesis existe también un nú-mero considerable de citocinas que la inhiben, tal y como sucede con el factor de necrosis tumoral-α
(TNF-α), el factor de crecimiento transformante- β (TGF-β), la proteína inflamatoria de macrófagos-
1α (MIP-1α) y los interferones (IFN), entre otras. Estas moléculas son capaces de disminuir los niveles
de células troncales y progenitoras hematopoyéticas mediante la inhibición de su proliferación; dicha
inhibición puede ocurrir de manera directa -por inducir la disminución de la expresión de receptores
de moléculas estimuladoras- o a través del efecto sinérgico entre dos o más factores, causando un
efecto supresor en la proliferación y formación de colonias hematopoyéticas (20-22).
Linfopoyesis•
Tal y como ocurre en la mielopoyesis, la producción de las células del linaje linfoide (linfocitos B, linfocitos T, células NK y algunas categorías de células dendríticas) es un proceso dinámico y complejo, el cual está determinado por combinaciones de factores intrínsecos y microambientales que guían
la diferenciación de progenitores linfoides a partir de las células troncales hematopoyéticas (23).
Definiendo a los Progenitores
Linfoides Tempranos
Está bien establecido que la diferenciación del linaje linfoide progresa gradualmente en la médula
ósea desde progenitores muy primitivos con potenciales múltiples hasta precursores restringidos
que pierden opciones de diferenciación en paralelo con una ganancia de funciones especializadas (23).
A lo largo de este progreso la transcripción del locus de la enzima que recombina los segmentos genéticos VDJ de la inmunoglobulina y del TCR, la recombinasa RAG1, marca a los progenitores
linfoides más primitivos del ratón, denominados ELPs (del inglés early lymphoid progenitors)
(24,25). Ellos son tempranos en términos de marcadores de superficie, factores de transcripción en
contexto, y tiempo requerido para su diferenciación, y muestran un tremendo potencial para generar todas las líneas de células linfoides. Siendo responsables de la mayor producción de células dendríticas plasmacitoides (pDCs) (26) y contribuyendo a la generación de las recientemente descritas células dendríticas asesinas productoras de interferón (IKDC) (27), los ELPs dan origen a los
progenitores linfoides comunes o CLPs, que son reconocidos como los más eficientes precursores de linfocitos B y células NK en la médula ósea
(28,29). Además, estos progenitores tempranos constituyen uno de los candidatos más probables para la colonización del timo y la iniciación de la linfopoyesis de T en el ratón (30).
En la médula ósea y el cordón umbilical del ser
humano una variedad de progenitores multipotentes residen en la fracción celular que no expresan en la superficie membranal ningún marcador de célula sanguínea madura, pero expresan
moléculas CD34. La aparición de CD10 y de la enzima desoxinucleotidil-transferasa terminal
(TdT) en dichas células es probablemente uno de los eventos iniciales que distinguen a los progenitores linfoides (31). Así mismo, el receptor de quimiocina CXCR4 es sustancialmente expresado en células con actividad precursora linfoide, de tal modo que se especula que podría ser un marcador distintivo de la contraparte de ELPs del ratón. Los posibles progenitores linfoides comunes (CLPs) expresan además el receptor de interleucina 7 (IL-7), CD38 y CD45RA, y aunque, tanto en cultivo como in vivo, muestran un
potencial residual hacia células T, NK y dendrí-ticas, se diferencian principalmente a linfocitos B (32). Por otro lado, células que expresan CD34, CD45RA y CD7, pero no expresan CD10 ni el receptor de IL-7, son altamente eficientes en la generación de células T y NK (33).
Desarrollo de las Células B
En la ontogenia, el desarrollo de las células B puede ocurrir en el epiplon y el hígado fetal, mientras que después del nacimiento se confina primordialmente a la médula ósea. Aún cuando la
información acerca de los eventos de transición a partir de los potenciales CLPs a los precursores de células B es muy limitada, se han identificado poblaciones funcionales que definen la vía de diferenciación río abajo, iniciando con las células B tempranas CD34+CD19-CD10+ y continuando con pro-BCD34+CD19+CD10+, pre-BI grandes CD34+CD19+CD10+, pre-BII grandes CD34-CD19+CD10+, pre-BII peque-ñas CD34-CD19+CD10+, B inmaduras CD34-
CD19+CD10+sIgM+ hasta la producción de B
maduras CD34-CD19+CD10-sIgM+sIgD+, que eventualmente serán exportadas a los tejidos linfoides periféricos para cumplir su función de reconocimiento de antígeno, activación y producción
de anticuerpos específicos. El proceso completo en la médula ósea requiere de la acción concertada de múltiples factores de transcripción, incluyendo Ikaros, PU.1, E2A, EBF y Pax-5. Los dos
primeros actúan paralelamente en el control de la transición de las células troncales a progenitores,
mientras que E2A, EBF y Pax-5 regulan secuencialmente el desarrollo de las células B tempranas
(34). La linfopoyesis de B en el humano parece cumplirse sin el requerimiento de algunas citocinas documentadas como esenciales para el proceso en el ratón, como la interleucina 7, y hasta
el momento se desconocen los factores de crecimiento y/o citocinas que la dirigen.
Desarrollo de las Células T
Debido a que el timo no produce progenitores de renovación autóloga, la linfopoyesis de T es mantenida por la importación periódica de progenitores hematopoyéticos a través de la corriente sanguínea (35), y aunquea múltiples progenitores se les reconoce cierto potencial para generar células T, no todos ellos tienen la propiedad de establecerse en este órgano. Las bases moleculares de su entrada no han sido totalmente elucidadas, pero se predice que pudiera ser un proceso secuencial análogo al ‘homing’ de leucocitos, esto es: adhesión débil al endotelio vascular mediado por selectinas, señalización vía quimiocinas, adhesión
fuerte a través de integrinas, y transmigración. Al respecto, los modelos experimentales han mostrado la importancia que CD44, P-selectina y CCR9 tienen en la colonización tímica (36).
Los precursores tímicos más tempranos (ETP) residen en la población CD34+CD1aCD38loCD44+IL-7R+ y a partir de ellos se inicia el proceso de compromiso de estadios intermedios de diferenciación desde células pre-T, células inmaduras CD4 uni-positivas pequeñas, células CD4 uni-positivas grandes, células tempranas doble-positivas (EDP), hasta los timocitos DP CD4+CD8+TCR+, los cuales darán origen a la diversidad de linfocitos T maduros CD4 y CD8 con capacidad de reconocimiento de antígeno y
activación. La participación de algunos factores de transcripción en éste proceso ha sido blanco de gran investigación, y actualmente es claro que las interacciones de los receptores Notch con sus ligandos juegan un papel crucial en el control de la diferenciación y proliferación de los precursores tempranos, dirigiendo así las decisiones de linaje de T en el timo (35), concomitante con la supresión del linaje de B. Así mismo, el balance de la expresión de las proteínas E y sus antagonistas naturales Id está implicado en la diversificación tímica T/NK (31), y el factor GATA3 es esencial para el re-arreglo apropiado de genes del receptor de células T.
Respecto a la importancia de las citocinas, se conoce que la linfopoyesis de T es críticamente dependiente de IL-7, lo que ha sido sustentado por la profunda deficiencia en células T (pero no B) que desarrollan los pacientes con inmunodeficiencia severa combinada por defectos genéticos en el gen que codifica para la cadena γc del receptor de IL-7, así como los pacientes deficientes en IL-7R (31).
Desarrollo de Células NK
Las células asesinas naturales (NK) pueden producirse en múltiples sitios. En el feto se han encontrado precursores en médula ósea, hígado, timo, bazo y ganglios linfáticos, mientras que en niños
y adultos la médula ósea es el sitio predominante de su desarrollo a partir de progenitores linfoides. Los factores de transcripción Id2 y Id3 controlan el desarrollo temprano de las células NK, mientras que los tres estadios que definen el proceso completo -el compromiso de linaje, la selección del repertorio de receptores NK y la maduración funcional- son críticamente dependientes de interleucina 15, que mantiene la viabilidad y sostiene la proliferación de las células en desarrollo (37).
Desarrollo de Células Dendríticas
A la fecha, el origen hematopoyético del creciente número de poblaciones de células dendríticas en el
humano está pobremente definido; sin embargo, la expresión de algunos genes asociados al linaje linfoide en las células plasmacitoides dendríticas (pDCs) sugiere una afiliación linfoide en la médula ósea, y datos recientes indican que Notch, en concierto con el factor de transcripción Spi-B pudieran regular la
diversificación de linaje T/pDC en el timo (38).
Microambiente Hematopoyético•
La hematopoyesis es un proceso finamente regulado que se lleva a cabo únicamente en ciertos
órganos, denominados órganos hematopoyéticos (saco vitelino, bazo, hígado, médula ósea).
En ellos las células hematopoyéticas se desarrollan en un ambiente específico denominado microambiente hematopoyético (MH) (39,40). El MH consiste en una estructura tridimensional,
altamente organizada, de células del estroma y sus productos (matriz extracelular, citocinas, quimiocinas, entre otras) que regula la localización y fisiología de las células hematopoyéticas (39,41).
Células del Estroma
La palabra estroma deriva del griego que quiere decir “cama” y del latín que quiere decir “colchón”
(39), ya que de acuerdo con la definición más antigua se pensaba que las células estromales únicamente proveían un soporte físico para las células hematopoyéticas. Uno de los grandes avances para
entender la biología de las células del estroma fue el desarrollo de los cultivos denominados a largo plazo
tipo Dexter (42), los cuales hasta la fecha son un modelo in vitro que permite el crecimiento de células hematopoyéticas y estromales de médula ósea por varias semanas (humano) e incluso meses (ratón)
(43). Este tipo de cultivos favorecen el crecimiento de una capa de células estromales, conformada
en su mayor parte por fibroblastos estromales, una proporción menor de macrófagos y por diferentes tipos celulares como adipocitos y osteoblastos, los cuales permiten el desarrollo de las células hematopoyéticas sin la necesidad de añadir ningún elemento o citocina exógena al cultivo. A esta capa heterogénea de células adherentes se le denomina genéricamente como estroma (Fig. 4) (44).
Para su estudio, las células estromales pueden ser clasificadas de acuerdo a su origen en dos componentes: el componente hematopoyético, conformado por los macrófagos estromales, los cuales derivan de las células troncales hematopoyéticas, y el componente mesenquimal, conformado por fibroblastos estromales, adipocitos y osteoblastos, los cuales derivan de la célula troncal mesenquimal.
Componente Hematopoyético
Los macrófagos estromales son los únicos elementos del estroma que presentan el antígeno CD45. Estas células pueden distinguirse gracias a que expresan moléculas específicas como las moléculas
del complejo mayor de histocompatibilidad clase II (MHC II), el antígeno CD14, CD11c y CD68.
Los macrófagos estromales son el segundo componente del estroma más abundante de la médula ósea y de los cultivos líquidos a largo plazo (39). Dentro de la médula ósea éstos se localizan en diferentes sitios: como macrófagos centrales en las islas eritroblásticas, en el endotelio y dispersos entre las
células hematopoyéticas. Estas células llevan a cabo diferentes y muy importantes funciones, regulando la hematopoyesis mediante interacciones célula – célula, y por medio de la secreción de citocinas
estimuladoras e inhibidoras de la hematopoyesis. Dentro de la variedad de citocinas producidas por
los macrófagos encontramos el factor estimulante de colonias de macrófagos (FEC-M), de granulocitos y monocitos (FEC-GM), diversas interleucinas (IL) como la IL-3, la IL-1, la IL-6, IL-8 y el factor de
necrosis tumoral alfa (TNFα) (39, 45,46).
Componente Mesenquimal
El componente mesenquimal se encuentra conformado por distintos tipos de células que provienen
de una célula troncal mesenquimal (47) y que, dependiendo de los factores que se encuentren en
su ambiente, sigue un determinado patrón de diferenciación hacia fibroblastos estromales, adipocitos, y osteoblastos. Estas células estromales de origen mesenquimal tienen un papel fundamental en la regulación de la hematopoyesis (48).
Fibroblastos Estromales
La mayor parte de las células estromales CD45- son células vasculares tipo músculo liso, también
conocidas como células reticulares o fibroblastos estromales o miofibroblastos (39,44,48). Estas
células presentan varios marcadores que comparten con las células de músculo liso vascular, como las proteínas de citoesqueleto: actina alfa de músculo liso y metavinculina, entre otras (48).
Estas células también expresan una variedad de moléculas de la matriz extracelular como vimetina, fibronectina, colágena tipo I, III y IV. En sistemas in vitro se ha demostrado que los fibroblastos estromales son capaces de mantener la hematopoyesis sin la adición de citocinas exógenas, ya que son capaces de sintetizar y secretar citocinas como la IL-1, 6, 7, 8, 11, FEC-M, FEC-G, el factor de crecimiento de células troncales (SCF) y el interferón-beta (IFN-β). Estas moléculas actúan sobre receptores específicos en las células hematopoyéticas, desencadenando cascadas de señalización que modulan la expresión de genes reguladores de proliferación, sobrevida, diferenciación, adhesión y secreción de citocinas. Los fibroblastos estromales también secretan una variedad de moléculas que forman parte de la matriz extracelular, como fibronectina (49), colágena tipo I y III, heparán sulfato, ácido hialurónico (50) las cuales interactúan
con las células hematopoyéticas gracias a que éstas expresan en su superficie una serie de moléculas
de adhesión, como VLA-4, VLA-5, αLβ2 integrina y CD44, entre otras (51,52). Las moléculas de
matriz extracelular también regulan la hematopoyesis a través de su interacción con citocinas, las
cuales son captadas por esta matriz confiriéndoles estabilidad, incrementando su tiempo de vida y
restringiendo su ubicación en el medio (49).Los fibroblastos estromales producen y secretan
quimiocinas, como el factor derivado del estroma (SDF-1), el cual regula la quimiotaxis de las células B y T, la migración de las células CD34+, así como suprime la apoptosis y promueve la transición G0/G1 de las células CD34+ (53). Tanto las citocinas, quimiocinas, moléculas de la matriz extracelular, moléculas de adhesión, son necesarias para regular la autorrenovación, diferenciación, maduración, proliferación, muerte (apoptosis) y migración de las células hematopoyéticas (39,45).
Osteoblastos
La función más conocida de los osteoblastos es la de regular la reabsorción del hueso induciendo la expansión, maduración y activación de los precursores de los osteoclastos. Los osteoblastos son el blanco primario de los estímulos de reabsorción del hueso, como las prostaglandinas y la 1,25-dihidroxivitamina D3 (54). El papel de los osteoblastos como parte del estroma hematopoyético no había sido comprendido debido a su escasez en los cultivos tipo Dexter y a la falta de métodos para aislarlos y cultivarlos.
Gracias a la técnica de cultivo por explante – en donde es cultivada una fracción de hueso de la médula ósea- se ha logrado establecer cultivos homogéneos de osteoblastos primarios (54).
Los osteoblastos producen una gran variedad de citocinas, capaces de regular la hematopoyesis, tanto positiva como negativamente. Se ha reportado la presencia de ARN mensajero que codifica para el FEC-G, FEC-M, el FEC-GM, la IL-1 y la IL-6. La producción de estas citocinas es basal, y puede ser regulada positivamente por IL-1, el TNFα y lipopolisacáridos. A nivel de proteína se ha corroborado la producción de G-CSF, GMCSF, IL-6; así como se ha encontrado la expresión del factor inhibitorio de la leucemia (LIF), TNFα, el factor de crecimiento vascular (VEGF), TGF-β y linfotoxina TNF-β (LT) (55).
Los osteoblastos han demostrado tener la capacidad para mantener la proliferación de células CD34+
en sistemas de co-cultivos (56-58). Se observó que estimulan preferentemente a los progenitores de
colonias granulocíticas (UFC-G), lo cual se debe probablemente a la secreción de grandes cantidades de
FEC-G en ausencia de estímulos de inflamación, a diferencia de lo que ocurre con otros tipos celulares
mesenquimales. De acuerdo con este modelo, los fibroblastos estromales, las células endoteliales y los
miofibroblastos estarían únicamente incrementando la granulopoyesis, pero no manteniendo la basal.
Los osteoblastos son capaces de producir factores que permiten a las células hematopoyéticas dirigirse a la médula ósea (homing), como la angiopoyetina 1 (Ang-1) (59) y el factor derivado del estroma (SDF-1) (60). La Ang-1 promueve la adhesión de las CTH a la fibronectina y colágena a través de su receptor Tie2,
permitiendo que las CTH se localicen en un sitio específico de la médula ósea (nicho) que promueve su
quiescencia y sobrevida. Se ha observado que la expresión de Ang-1 por parte de los osteoblastos es
fundamental para el establecimiento de la hematopoyesis definitiva en la médula ósea. Al parecer, los osteoblastos presentan en su superficie varios receptores que permiten localizar a las células hematopoyéticas más primitivas, como el receptor de vitronectina (αVβ3), N-caderina, Tie2 y Jagged-1. Estos hallazgos han permitido establecer que los osteoblastos forman una zona o “nicho” que favorece la expansión de las CTH, lo cual tiene una gran relevancia no solo en la investigación básica sino en la clínica (62,63).
Adipocitos
La presencia de adipocitos en el estroma post-natal depende de varios factores: 1) el estadio de desarrollo del esqueleto, ya que se ha observado que la adipogénesis progresa de la diáfisis a la epífisis; 2) la edad, el número de adipocitos incrementa con la edad; y 3) el nivel de hematopoyesis, debido a que la adipogénesis aparentemente correlaciona de manera inversa con la celularidad, y con la proporción del hueso que está llevando a cabo hematopoyesis (44). Su papel en la hematopoyesis no es muy claro, se ha propuesto que sean inhibidores de la hematopoyesis (39,45), que regulen el tamaño del
nicho hematopoyético o que su regulación sea a través de la secreción de leptina (64).
La Hematopoyesis y las Enfermedades Hematológicas•
Es evidente que la hematopoyesis es un proceso muy complejo, en el que participan diversos tipos
celulares y sus productos; todos éstos interactúan estrechamente para permitir que la producción de
células sanguíneas ocurra de manera controlada.
Es también claro que al ocurrir alteraciones en algunos de los compartimientos celulares del sistema hematopoyético, sobre todo en los más primitivos, la producción de células sanguíneas puede
verse modificada, de manera que los niveles de células circulantes sean abatidos drásticamente
o incrementados muy por encima de lo normal; cualquiera de éstas condiciones puede conducir
a estados fisiológicos muy delicados, e incluso, a muerte del individuo. Enfermedades como la
anemia aplásica, las leucemias mieloides (tanto crónica como aguda), las leucemias linfoides y los síndromes mielodisplásicos se originan a partir de alteraciones en células troncales y progenitoras hematopoyéticas (65-68). Hoy en día tenemos un mayor conocimiento acerca de los genes involucrados en la transformación maligna que conduce a ciertas leucemias (69), tenemos una idea muy clara sobre la identidad de las células inmaduras en donde ocurren dichas transformaciones (70) y del papel que el microambiente hematopoyético parece jugar en la fisiopatología de leucemias y síndromes de falla medular (71). Sin embargo, son
todavía muchas las preguntas que quedan por contestar. Desde el punto de vista biológico, todas éstasenfermedades constituyen campos de estudio extraordinarios; desde el punto de vista clínico, el tratamiento y la prevención de ellas representan grandes retos para la medicina del siglo XXI.
Interesante Información, sin embargo hay mucho texto seria bueno incluir un vídeo.
ResponderEliminarsaludos
m,uy interesante la informacion compañera.. me sera de mucha ayuda.. gracias por compartir esta informacion. tenias ciertas dudas pero me quedan aclaradas.
ResponderEliminar